|
Физическим газом называется вещество, находящееся в газообразном состоянии.
«Идеальный газ» – это название модели, описывающей физический газ, находящийся в сильно разреженном состоянии (при не слишком больших давлениях и достаточно высоких температурах). Уравнением, связывающим параметры состояния идеального газа, является уравнение Менделеева–Клапейрона. Поэтому оно имеет второе название: уравнение состояния идеального газа. Его вид известен: pV = νRT, где p – давление газа, V – объем газа, ν – количество киломолей, R – универсальная газовая постоянная, T – температура газа.
Более точная модель физического (реального) газа была предложена Ван-дер-Ваальсом. Она также является приближенной, но лучше описывает процессы, нежели модель «идеальный газ». Иногда эту модель называют «реальный газ». Газом Ван-дер-Ваальса (ВдВ) называется воображаемый газ (модель), параметры состояния которого точно подчиняются уравнению
Оно называется уравнением Ван-дер-Ваальса. Здесь a и b – константы Ван-дер-Ваальса.
Добавка к внешнему давлению (а) обусловлена взаимным притяжением молекул друг к другу.
Поправка к объему (b) характеризует ту часть объема, которая недоступна для движения молекул. Она равна нескольким суммарным объемам молекул, содержащихся в газе.
Изотермой называется зависимость давления от объема данного (фиксированного) количества вещества при постоянной температуре.
Рис. 1 изотермы некоторого физического (реального) газа. Рис. 2 и рис. 3 – изотермы ВдВ-газа (см. учебник Савельева).
Изотерма ВдВ-газа, имеющая только точку перегиба и не имеющая экстремумов, называется критической. Температура критической изотермы называется критической температурой. Объем и давление в критической точке также называются критическими.
Уравнения для критических параметров:
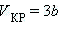 , , 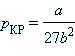 , , 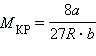 . .
Отсюда 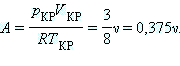
При температуре выше критической вещество может находиться только в газообразном состоянии. При температуре ниже критической вещество может находиться как в газообразном, так и в жидком состоянии.
Жидкое состояние описывается левыми (по отношению к точке перегиба) частями графиков на рисунках и характерно тем, что небольшое уменьшение объема вещества может произойти только при резком увеличении давления (жидкость практически несжимаема).
Изотермы ВдВ примерно совпадают с изотермами реального газа на участках, соответствующих однофазным состояниям вещества.
Рис. 3 разъясняет поведение вещества при разных внешних условиях. В области, где присутствуют две фазы (1–2–3–4), S-образный завиток изотермы ВдВ заменяется горизонтальным участком (1–4) реальной изотермы (см. учебник).
Нереализуемое состояние соответствует участку 2–3, на котором сжимаемость 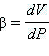 вещества была бы отрицательна, что невозможно.
вещества была бы отрицательна, что невозможно.
Переохлажденный пар на участке 3–4 реализуется при определенных условиях (при практическом отсутствии центров конденсации и внешних воздействий).
Перегретая жидкость на участке 1–2 реализуется при отсутствии примесей, способных быть центрами кипения.
|